摘 要:试验研究了低温淀粉酶在不同pH值条件下的耐酸性能及在饲料制粒前后的活性变化。试验结果表明:低温淀粉酶经pH3.5、pH4.0、pH4.5、pH5.0的乙酸-乙酸钠缓冲液处理4h后,酶活存留率分别为92.5%、97.1%、97.9%和98.8%;在70℃和85℃制粒温度条件下,制粒30s,酶活存留率分别为93.4%和88.1%。以上结果说明,低温淀粉酶具有优良的耐酸性能,并具有良好的热稳定性,能抵御饲料制粒过程中的高温。
关键词:低温淀粉酶;耐酸性能;制粒;热稳定性
淀粉酶是淀粉消化和吸收的关键酶。动物对淀粉的消化和吸收主要依靠淀粉酶的水解作用。幼龄动物由于消化系统发育不成熟,自身分泌的淀粉酶不足以充分消化饲料中的淀粉,影响 动物生长性能的发挥,并造成原料的浪费。因此,饲料中添加外源性淀粉酶可以极大提高动物对淀粉的消化吸收,改善生长性能,提高饲料的利用率。目前在饲料中普遍使用的淀粉酶是中温淀粉酶。中温淀粉酶属于工业用酶制剂,主要使用在食品、印染、化纤等领域。中温淀粉酶的最适作用是70~80℃,在动物体温条件下活性很低;中温淀粉酶耐酸性差,pH5.0以下严重失活;胃蛋白酶对其活性破坏严重,因此无法通过胃而进入肠道发挥作用。饲料工业极需开发专门适合动物胃肠道消化生理特点并发挥确实有效作用的淀粉酶。
低温淀粉酶是相对于中温淀粉酶而言,其最适作用温度比中温淀粉酶低20~30℃,在动物体温条件下具有较强的生物学活性。低温淀粉酶克服了中温淀粉酶作用温度高的缺陷,使其在动物饲料中的应用具有广阔的市场前景。然而,酶的本质是一种蛋白质,对酸碱、热都较为敏感。酶制剂发挥作用的大小不仅与作用温度有关,其活力还受作用底物、作用pH环境等多种因素的影响。低温淀粉酶虽然在较低的温度条件下可以发挥较强的活力,但它的耐酸性能和耐热性能依然是目前饲料企业比较关注的两个主要问题。调质制粒是饲料生产中常见的热处理加工方式。一方面,制粒可以使蛋白质变性,淀粉糊化,改善饲料的适口性,提高动物对饲料的利用率,但在制粒加工过程中,由于蒸汽的加入和压膜处理时的摩擦,制粒过程中的温度可达85℃,这种高温、高湿的加工环境会严重破坏酶的活性[1];另一方面,动物采食含有酶制剂的饲料后,首先进入到胃部,而胃内属于强酸环境,并分泌有胃蛋白酶等内源性消化酶,外源性淀粉酶能否经受出胃部的强酸环境和胃蛋白酶的水解作用而依然保持高活力,这些都需要作具体的评估。因此,研究低温淀粉酶的耐酸性能以及能否抵御饲料制粒过程中的高温对其开发和应用具有重要的价值和意义。
本研究通过对低温淀粉酶在不同pH值条件下的耐酸性能进行评估,并通过在饲料中添加低温淀粉酶,研究制粒前后低温淀粉酶活力的变化情况,以期为低温淀粉酶的应用提供有价值的参考依据。
1 材料和方法
1.1 试验材料
低温淀粉酶由杭州保安康生物技术有限公司提供,商品名为安酶乐,按照1.2方法测定酶活为3120U/g。
1.2 酶活测定方法
1.2.1 主要试剂
30%碘化钾溶液、25%浓硫酸溶液、0.05mol/l硫代硫酸钠溶液、1mol/l乙酸-乙酸钠缓冲溶液,可溶性淀粉溶液、费林试剂、胃蛋白酶。
1.2.2 测定方法
将可溶性淀粉溶液加到100mL Erlenmyer 三角瓶中,置于(40±0.5)℃恒温水浴中。预热10~15min加入样品稀释酶液,准确加热30min后。加入费林试剂使酶失活。将三角瓶直接在电炉上加热2min后,立即冷却至室温。随后加入30%碘化钾溶液和25%硫酸溶液,用0.05mol/l硫代硫酸钠溶液滴定游离出的碘,以蓝色消失作为滴定终点T30(mL)
空白对照试验:以水取代酶液。在另一个三角瓶中用上述同样的操作步骤测定空白对照值T0(mL)。临近终点时,加入1%可溶性淀粉溶液1~2滴,以蓝色消失作为滴定终点。
酶活力单位定义为:1g固体酶粉于40℃、pH值5.0条件下,反应30min,反应液中产生相当于10mg葡萄糖的还原糖所需的酶量为1个酶活力单位。
淀粉酶活力(U/g)=(T0-T30)×f×1.62×1/10×n
式中:T30—酶反应液滴定消耗硫代硫酸钠标准溶液的体积(mL)
T0—空白溶液滴定消耗硫代硫酸钠标准溶液的体积(mL)
f—0.05mol硫代硫酸钠溶液浓度的校正系数
1.62—换算系数
1/10—该分析方法的常数(相当于10mg葡萄糖的还原糖)
n—样品的稀释倍数。
平行试验相对误差不得超过5%
1.3 低温淀粉酶在不同pH值条件下的耐酸性能评估
1.3.1 样品处理
精确称取1.0 g低温粉酶和1.0g胃蛋白酶置于250 mL三角瓶中,分别用50 mL pH3.5、4.0、4.5、5.0的乙酸-乙酸钠缓冲液充分溶解,置于振荡器上振荡1h、2h、3h、4h。
1.3.2 酶液稀释
振荡结束后,将酶液小心倾入100 mL容量瓶中,再加少量乙酸-乙酸钠缓冲液润洗,最终将样品全部移入容量瓶中,用乙酸-乙酸钠缓冲液定容至100mL,摇匀。用滤纸过滤,滤液待用。
1.3.3 活性检测
取1.3.2滤液,按照1.2方法进行酶活测定。
1.4 饲料制粒过程对低温淀粉酶活力的影响
1.4.1 试验饲料
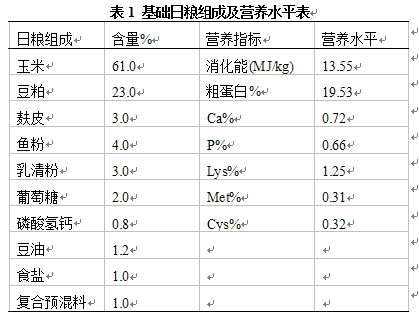
试验饲料采用玉米—豆粕型日粮,由浙江衢州嘉恒饲料有限公司提供仔猪饲料生产配方,并代为加工生产颗粒饲料。生产日粮配方见表1。
1.4.2 试验设计
将低温淀粉酶添加到仔猪饲料生产配方中,分别测定制粒前后低温淀粉酶的活力,计算酶活存留率。由于一般配合饲料中酶含量很低,为了准确评估低温淀粉酶经饲料制粒后的酶活存留率,本试验采用在饲料配方中添加高比例的低温淀粉酶,然后进行高温制粒的方法进行评估。具体做法是按照表1的生产配方准确称取400kg,然后添加100kg低温淀粉酶进行制粒生产。
饲料制粒加工过程条件设计,分别设定70℃、85℃两种不同的制粒温度,湿度16~18%,调质时间为30s,蒸汽压力0.4MPa,环模压缩比7:1进行制粒。
1.4.3 酶活测定取样
制粒前取样:将表1中的各种饲料原料按比例准确称取400kg之后,混匀,再准确加入低温淀粉酶100kg,再混匀,然后取样,即在制作颗粒之前随机抽样。试验时采用逐级扩大法充分混入基础饲料中,混合均匀后按四分法取样500g,备酶活性测定用。
制粒后取样:将各原料混匀后,加水调质,制成直径为2.0mm颗粒料,再分别取样500g,自然晾干,备酶活性测定用。
1.4.4 活性检测
准确称取1.0g待测样品,稀释1200倍,按照1.2方法测定酶活。
1.5 试验结果分析
试验结果用SPSS11.5 统计软件进方差分析和多重比较。
2 试验结果与分析
2.1 低温淀粉酶在不同pH值条件下的耐酸性能评估
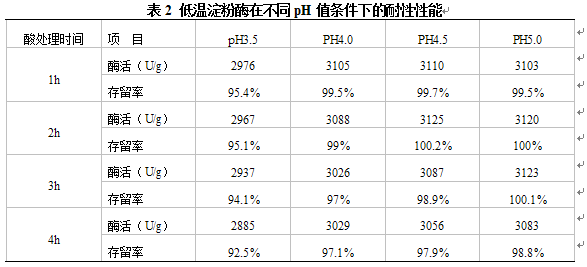
低温淀粉酶在pH3.5、4.0、4.5、5.0条件下,加入100U/mL胃蛋白酶经乙酸-乙酸钠缓冲液处理1h、2h、3h、4h后,测定低温淀粉酶活力,计算酶活存留率,结果见表2。
从表2的测定和计算结果可以看出:
1、低温淀粉酶经pH值4.0、4.5、5.0的乙酸-乙酸钠缓冲液和胃蛋白酶处理4h后,酶活存留率分别为97.1%、97.9%和98.8%,结果都在5%的测定误差允许范围内,说明低温淀粉酶活性基本没有损失;在强酸条件下,低温淀粉酶经pH3.5的乙酸-乙酸钠缓冲液和胃蛋白酶处理4h后,酶活存留率仍都保持在90%以上,说明低温淀粉酶具有良好的耐酸性能,并能抵御胃蛋白酶的水解作用。
2、幼龄动物消化系统发育不成熟,分泌胃酸的能较弱。仔猪30日龄以内胃部pH仍保持在4.0以上,40日龄降到3.3,采食动物饲料后胃内容物pH约为4.0~5.0。从表2的测定结果可以看出,低温淀粉酶完全可以耐受仔猪的胃酸环境。由于食糜在猪胃内有2~3个小时的停留时间,胃部具备低温淀粉酶发挥作用的温度和pH环境,因此低温淀粉酶在仔猪胃内即可发挥部分水解作用。鸡的嗉囊pH较高约为5.0~6.0,在进入肌胃消化之前,低温淀粉酶在嗉囊内同样可以发挥较大作用。
2.2 饲料制粒过程对低温淀粉酶活性的影响
低温淀粉酶在70℃、85℃制粒温度条件下,制粒30s,测定制粒前后低温淀粉酶活力,计算酶活存留率,结果见表3。
从表3的测定和计算结果可知:
1、经过70℃的制粒温度,低温淀粉酶的酶活存留率为93.4%,酶活有一定损失;经过85℃的制粒高温后,低温淀粉酶的存留率仍高达88.1%,说明低温淀粉酶经过饲料制粒高温处理后稳定性良好,能抵御饲料制粒过程中的高温。
2、根据冯定远提出的饲用酶制剂发挥作用位置的二元说理论,即酶不仅在动物消化道中发挥效能,在饲料高温加工过程中酶也可以部分发挥催化作用[2]。饲料制粒过程中的 温度上升有一个过程,是一个从常温到高温渐进的上升过程。在本试验中,当制粒温度从常温上升到70℃和85℃的过程中,有一段温度范围与低温淀粉酶的最适作用温度相吻合,在这段范围内,低温淀粉酶可能已经对淀粉进行了部分水解。因此,所测得的酶活损失率不仅包括因制粒高温造成的酶损失率,也包括在制粒过程中已经发挥水解作用的那部分酶的损失率以及测定误差。
3 讨论
3.1 饲用酶制剂产品标示的酶活大小和动物使用效果并不成正比。
目前饲料企业对酶制剂的评估往往仅通过产品所标示的酶活大小来比较和判定酶的质量优劣和作用效果。饲 用酶制剂与食品、化纤等工业用酶制剂最大的不同之处,就在于工业用酶制剂的使用通常有比较确定的作用温度、底物、时间和pH环境,而且酶活成分也比较单一明确,酶的作用效果相对比较容易评估[3]。而饲用酶制剂的作用环境则较为复杂,从酶制剂生产完成到在动物胃肠道内发挥作用需要经过饲料原料混合加工、高温制粒、运输、储存以及胃酸和胃蛋白酶的破坏等一系列过程和变化,这些过程和变化甚至可能会导致酶活性的完全丧失。因此,产品所标示的酶活大小和使用效果并不成正比。动物胃内的强酸环境和饲料制粒过程中的高温是造成酶活力丧失的两个主要因素。有些酶无法耐受胃酸和胃蛋白酶的破坏或制粒过程中的高温,到达动物肠道后其活力可能已经损失殆尽。体外测定酶活高的酶制剂,动物使用后不一定会有好的使用效果,仅仅依靠酶活作为评价酶制剂的使用效果并不科学。因此,研究低温淀粉酶的耐酸性能及其在制粒加工过程中的稳定性对其作用效果的评估具有重要的应用价值。
3.2 饲用酶制剂的耐酸性能评估。有关饲用酶制剂耐酸性评估的报道不多。
幼龄动物的消化生理特点与成年动物不同。仔猪分泌胃酸的能力较弱,20日龄的仔猪胃液pH为3.5,30日龄为4.29,40日龄为3.2~3.5,4月龄时胃酸浓度才达到成年猪水平pH2.5~3.5[4]。一般商品仔猪饲料pH5.8~6.5,仔猪采食饲料后胃内容物pH值可上升到4.0~5.0。本试验结果表明,低温淀粉酶可以抵御胃酸和胃蛋白酶的破坏。在进入肠道之前,食物在猪胃内有数小时的停留时间,此时低温淀粉酶在胃内即可把淀粉水解为糊精、低聚糖、麦芽糖、葡萄糖等易于被肠道消化吸收的成分,减少小肠的消化负担,提高淀粉的消化吸收。与猪消化生理特点不同,鸡具有特有的嗉囊结构,饲料在进入鸡pH值较低的肌胃之前,较高pH值环境的嗉囊具备低温淀粉酶发挥作用的温度和环境,低温淀粉酶在嗉囊内就可把淀粉进行初步分解,然后再进入肌胃和小肠进行深度消化和吸收。
3.3 饲用酶制剂的耐饲料制粒高温性能评估。
酶制剂在饲料制粒过程中的稳定性是一直饲料企业比较关注的问题。为探讨这一问题,很多学者在实验室条件下通过在试管中加热酶的方法来证明酶制剂的热稳定性。干热法、湿热法和水浴法是目前最常用的酶热稳定性能评价方法[5-7]。干热法是将酶制剂置于干燥箱中,在高温下处理一段时间测定酶活性损失的方法。湿热法是在干热法基础上加入湿度的因素,通过添加纯化水调节酶样的水分至16%,然后在恒温烘箱中高温处理一段时间检测酶活损失率。水浴法通过调节水浴温度和水浴时间来反映高温对酶活性的影响。此法操作最简单,但反应条件与实际制粒条件差异明显。当体系中含有大量的自由水时,维持酶空间构象的化学键因完全直接暴露在高温和高湿环境中更容易受到破坏,酶也容易失活变性,因此测得的酶活存留率比实际值要低很多。上述几种方法虽然考虑了高温、湿度和作用时间对酶制剂的影响,但没有考虑作用底物的影响,与实际制粒条件差异较大,测得的数据并不能反映饲料制粒过程中酶的真实损失率。本试验通过在饲料制粒过程中,评价制粒前后低温淀粉酶的酶活存留率,数据更加客观、真实和准确。
3.4 低温淀粉酶的耐酸性和耐饲料制粒高温机制。
关于低温淀粉酶的耐酸性机理还没有明确的定论,但已有研究者通过对耐酸性淀粉酶蛋白的氨基酸组成分析,发现耐酸性淀粉酶所含酸性和碱性氨基酸的比例较少,因而推测其耐酸性可能与其在低pH条件下的带电性有关[8-9]。当pH值低于等电点时,碱性氨基酸残基带有正电荷,大量正电荷相互排斥,导致蛋白质结构展开,从而影响酶催化中心的活性。如果酶蛋白中的酸性和碱性氨基酸含量较低,则带电量较小,pH值的变化对酶活性的影响不大,所以含有较低带电氨基酸可能是低温淀粉酶具有酸稳定特性的原因。温度是酶反应速率的决定条件,低温条件下酶促反应一般是较难进行的,然而低温淀粉酶却能在低温条件下有效发挥催化作用,说明低温淀粉酶有一套独特的催化机制。GeorgesFeller等人通过对中、高温淀粉酶的结构比较与分析,发现低温淀粉酶活性中心非常保守,并未发现特殊结构,但低温淀粉酶分子表现出很强的柔韧性,使其在低温条件下仍可与底物分子结合发挥作用[10]。现在普遍认为低温淀粉酶的低温适应机制主要是酶分子内部基团之间相互作用的减弱及酶和溶剂分子之间的相互作用加强的结构。这样的分子结构变化使得酶分子具有更好的柔韧性,增强了其与底物的作用范围,降低了反应所需的活化能,从而提高了它们在低温下的催化活性[11-12]。本试验结果表明,低温淀粉酶对制粒过程中的85℃高温表现出良好的稳定性。其耐热机制推测可能与低温淀粉酶的空间结构有关。在高温条件下低温淀粉酶通过疏水作用、氢键、盐键和静电作用等次级键可能更趋向于折叠形成具有高稳定性和催化活性的刚性空间结构以抵抗高温的破坏作用。
3.5 饲用酶制剂的耐饲料制粒高温评估方法。
有关饲料制粒后酶活变化的文献不多,主要是没有一种有效测定制粒前后配合饲料中酶活的检测方法。一方面是因为配合饲料中酶含量低较难测定,另一方面是由于受到多种底物的干扰而影响测定结果。本研究中饲料中的淀粉可能会对酶活测定产生较大误差。为了尽量减少酶活的分析误差,试验中采用了高比例的低温淀粉酶添加量,同时提高检测时的稀释倍数来降低底物的干扰。以饲料中含淀粉率为45%计,稀释1200倍后,待测酶液中含有0.375mg/mL淀粉,相当于反应液中淀粉酶底物的量增加0.375mg,与标准反应液中50mg的淀粉底物相比较,增加了0.75%,并且测定过程中设有空白对照,因此饲料中的淀粉对测定结果的影响基本可以忽略不计。
4 结论
本研究结果表明,低温淀粉酶不仅具有良好的耐酸性能,还具有良好的热稳定性,能抵御饲料制粒过程中的高温,适用于在饲料制粒工艺,具有较大的应用前景。
参考文献
[1] 杨红军,时建忠,顾宪红.制粒和膨化对饲料营养成分的影响[J].2006,17:32-34.
[2] 冯定远,左建军,周响艳.饲料酶制剂理论与实践的新假设—饲料酶发挥作用位置的二元说及其意义[J].饲料研究,2009,8:1-5.
[3] 陆文清,李德发.评价饲料酶品质的5种指标[J].饲料研究,2005,3:10-13.
[4] 张心如,罗宜熟,杜干英,等.猪消化道酸度与调控[J].养猪,2003,4:51-53.
[5] 李清峰,马向东,彭虹旎,等.木聚糖酶耐热性研究进展[J].中国畜牧杂志,2009,45(11):57-60.
[6] 马俊孝,卢彦梅,刘伟,等.植酸酶耐热性评价方法的研究[J].饲料工业,2011,32(18):28-30.
[7] 王海燕,汤海鸥,王晓睿,等.耐高温植酸酶的热稳定性评估方法分析[J].饲料工业,2013,34(20):15-18.
[8] 李勃.微生物发酵生产耐酸性α-淀粉酶的研究:[硕士学位论文][D].西安:西北大学,2009.
[9] 颜守保.产耐酸性α-淀粉酶菌株的筛选、发酵条件及酶学性质研究:[硕士学位论文][D].合肥:安徽农业大学,2007.
[10] Feller G,Payan F,Theys F,et.Stability and structural analysis of alpha-amylase from the antarctic psychrophile alteromonas haloplanctis A23[J].European Journal of Biochemistry,1994,222(2):441-447.
[11] 徐玲,唐茂妍,陈旭东.低温淀粉酶的耐温性研究[J].饲料工业,2010,31(24):13-15.
[12] 韩萍,魏云林.α-淀粉酶低温适应性分子机制的研究进展[J].微生物学杂志,2006,26(4):77-81.